Le chemo free dans le traitement des LAL Ph+ de l’adulte : l’histoire se poursuit
Combinaison ponatinib et blinatumomab chez les patients avec leucémie aiguë lymphoblastique à chromosome Philadelphie : résultats actualisés d’une étude de phase 2.
Ponatinib and blinatumomab for patients with philadelphia chromosome-positive acute lymphoblastic leukemia: updated results from a phase 2 study.
D’après la communication orale de N Short et al. Abstract #S114, EHA 2022.
Contexte de l’étude
Après l’étude des italiens D-ALBA publiée dans The New England Journal of Medicine en 2020 et montrant l’efficacité de l’association dasatinib blinatumomab,c’est au tour de l’équipe du MD Anderson de présenter ses résultats avec la combinaison ponatinib, inhibiteur de tyrosine kinase de 3ème génération et blinatumomab.
Objectifs de l’étude
Il s’agit avant tout d’évaluer l’efficacité et la tolérance de la combinaison BLINA PONA dans 3 cohortes de patients (pts) : les pts LAL Ph+ nouvellement diagnostiquée (ND), les LAL en rechute ou réfractaire (R/R) ou les transformations aiguës lymphoblastiques de LMC (LMC-LBP).
Pour les pts LAL Ph+ ND, le critère d’évaluation principal était le taux de réponse moléculaire complète (RMC) alors que pour les pts LAL Ph+ R/R, c’était le taux de rémission complète (RC) avec ou non une récupération hématologique incomplète (RCi). Les critères d’évaluation secondaires comprenaient tolérance, la survie sans événement (EFS) et la survie globale (SG).
Résultats de l’étude
Le schéma thérapeutique est représenté figure 1. À noter que le ponatinib était donné à 30mg par jour jusqu’à l’obtention de la RMC puis diminué à 15mg/j ; les pts recevaient également 12 injections intrathécales prophylactiques. La maintenance par ponatinib durait 5 ans. Cinquante-cinq pts ont été traités de 2018 à 2022 : 35 avec LAL Ph+ ND, 14 LAL Ph+ R/R et 6 avec LMC-LBP.
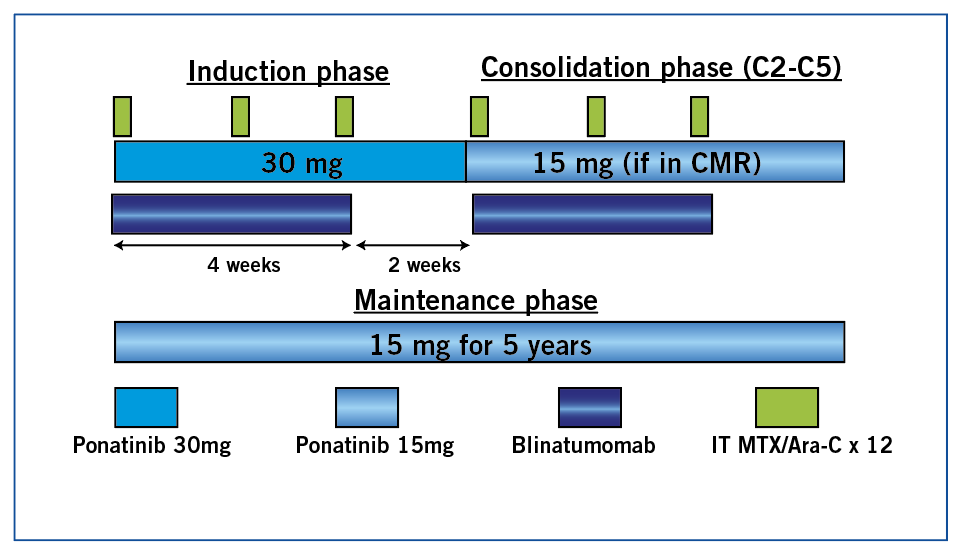
Figure 1 : ponatinib + blinatumomab dans les LAL Ph+. Schéma thérapeutique.
Dans la cohorte de LAL Ph+ ND, un patient est décédé précocement dû à une hémorragie intracrânienne et un autre est décédé en RC ce qui fait que l’évaluation après cycle 1 se fait sur 33 patients avec 21/33 pts (64%) qui atteignent la CMR et 28/33 pts (85%) qui atteignent la CMR à tout moment (figure 2). Un seul patient a été allogreffé compte tenu d’une MRD BCR/ABL1 en NGS persistante à 0,01%. L’EFS et la SG à 2 ans sont toutes deux de 93 %. Il n’y a pas eu de rechutes ou de décès liés à la leucémie dans cette cohorte.
Pour la cohorte LAL Ph+ R/R, la CR/CRi a été obtenue dans 12/13 (92%) pts évaluables, la CMR a été atteinte chez 10 pts (71%) après le cycle 1 et en 11 pts (79%) dans l’ensemble (figure 2). Le taux d’EFS à 2 ans était de 42% et le taux de SG à 2 ans était de 61%.
Dans la cohorte CML-LBP, 5/6 ont atteint la CR/CRi, et 2 patients (40%) ont atteint la CMR. L’EFS à 2 ans était de 33% et le SG à 2 ans était de 60%.
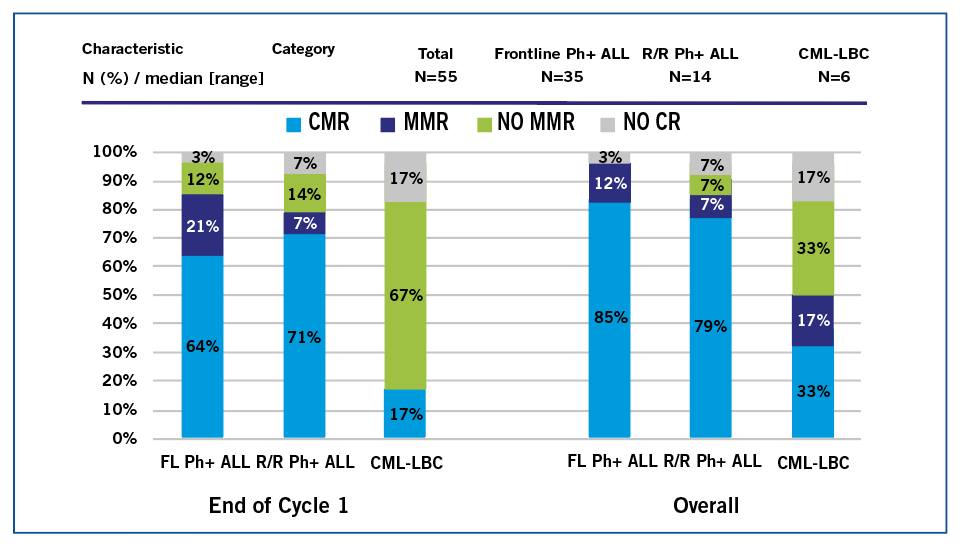
Figure 2 : résultats sur les MRD selon les 3 cohortes.
Quels impacts sur les connaissances et les pratiques cliniques ?
Cette combinaison a été bien tolérée et la plupart des toxicités étaient de grade 1 à 2 et correspondaient aux toxicités connues des deux agents.
Par rapport à l’étude italienne D ALBA où le blinatumomab n’était associé qu’à partir de 3 mois (le patient ne recevant que dasatinib, corticoïdes et intrathécales pendant les 3 premiers mois), cette étude positionne le blinatumomab dès le départ, avec il est vrai, un taux de RMC impressionnant après seulement 1 cycle de traitement. Des suivis à long terme de ces cohortes sont donc nécessaires pour savoir si cette réponse profonde précoce se traduit en une meilleure survie sans rechute sur le long terme. Dans le futur protocole GRAAPH, c’est une combinaison à 3 qui est prévue avec chimiothérapie blinatumomab et ponatinib et surtout une randomisation de l’allogreffe chez les patients bons répondeurs.
Pour finir, un point intéressant est le monitoring de la MRD dans cette étude :
la maladie résiduelle est établie ici sur le transcrit BCR/ABL, or il est de plus en plus démontré que le réarrangement Ig/TCR est plus à même de refléter le clone lymphoblastique résiduel, BCR/ABL pouvant persister comme témoin d’une hématopoïèse clonale (voir le travail d’Emmanuelle Clappier).
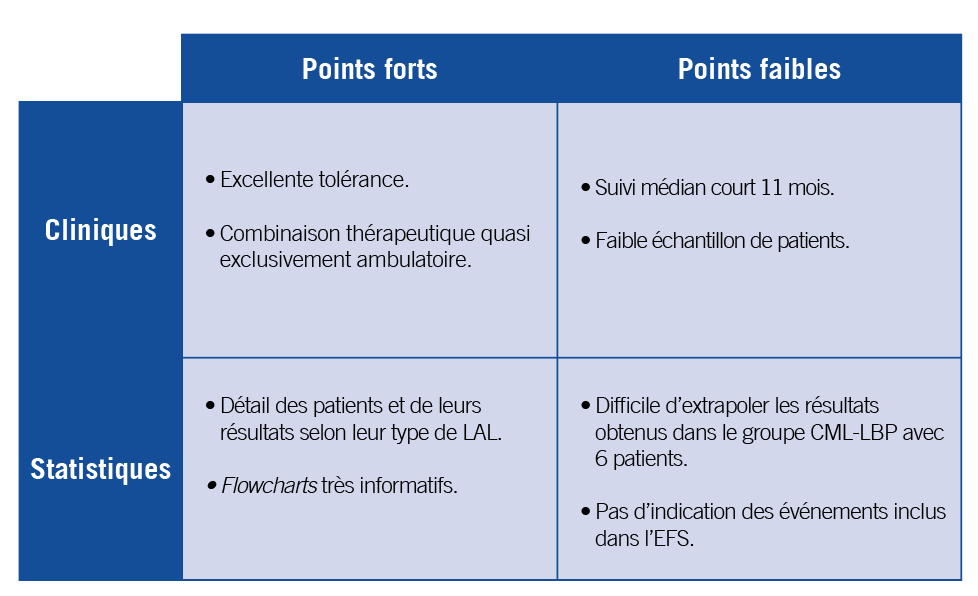
Critique méthodologique
Cet essai de phase 2 a pour co-objectifs primaires un seul endpoint, le taux réponse moléculaire complète (CMR), mais unendpoint commun qui doit être atteint dans 3 sous-populations incluses dans cette étude : chez les LAL Ph+ ND, chez les réfractaires/rechutes toujours phi+ et les LMC transformées. La survie globale et sans événement (EFS), ainsi que la safety étaient retenus comme critères secondaires, mais on ne connaît pas quels sont les événements retenus dans l’EFS (on peut supposer le décès, la rechute ou progression, et quels autres exactement ?). Les autres points de détail méthodologiques ne sont pas exposés de manière aussi claire que la posologie des molécules en présence dans les différentes phases de cet essai.
Étant donné que l’objectif principal s’attarde sur 3 groupes de patients, il est normal d’afficher le descriptif comparatif des 55 patients, comptant 35 patients dans le groupe frontline, 14 rechutes/réfractaires et les 6 – seulement – issus d’une phase accélérée ou blastique de leucémie myéloïde chronique. Il n’y a pas de test statistique pour indiquer si l’âge et les quelques autres paramètres se répartissaient de manière équivalente entre les 3 sous-populations ou non. Comme attendu, les taux de réponse sont aussi affichés en global et par groupe, également sans test statistique, ne serait-ce que pour indiquer s’ils sont comparables entre eux de manière purement informative. Il peut être discutable qu’un groupe de seulement 6 patients pour les CML-LBP ne peut permettre d’établir des conclusions un minimum robuste (2 CMR ont été comptabilisés dans ce petit groupe). On peut aussi légitimement se poser la question de savoir si c’est réellement utile de raisonner en termes de pourcentage de niveau de réponse pour comparer les résultats avec un effectif si faible, et dans l’ensemble, non équilibrés entre les 3 types de patients. En revanche l’emploi d’une arborescence pour décrire le devenir des patients par groupe et en fonction de leur niveau de réponse est plutôt judicieux et bien synthétique, permettant d’essayer de deviner quels sont les événements potentiellement utilisés pour l’EFS (non-réponse, allogreffe ?).
Les courbes de survie sont aussi affichées par groupe, superposées entre R/R et CML-LBP sans qu’on observe de différence visuellement, les auteurs s’affranchissant d’un test de log-rank pour les comparer avec les LAL de novo (les effectifs sont relativement suffisants pour en faire un versus les R/R plus LMC transformées par exemple). De nouveau, cela peut être discutable en termes de puissance et de comparabilité des groupes de patients.
Pour résumer, cette étude de phase 2, comme d’autres avant elles, questionne notre rapport au recours systématique ou non de tests statistiques ou de tel type de descripteurs statistiques (pourcentages notamment) au regard des effectifs en présence, pour appuyer ou nuancer les interprétations et les conclusions.